基因治疗位于医疗技术研发的最前沿,目前其临床试验项目中以II期阶段为主,全球以美国和中国为主导,市场需求持续升温。以基因技术为基础的治疗手段被一些研究认为更具针对性,且能减轻患者痛苦,随着技术发展,它正在超越治疗遗传疾病的范畴,基因治疗方案和药物在全球范围内接连获批。据Evaluate Pharma,预计在未来6年内,将有多达60种基因疗法获得批准。当前罕见病、肿瘤治疗已成为基因治疗的重要应用方向。
大型制药公司纷纷布局,罕见病、癌症成为基因治疗的重要应用领域
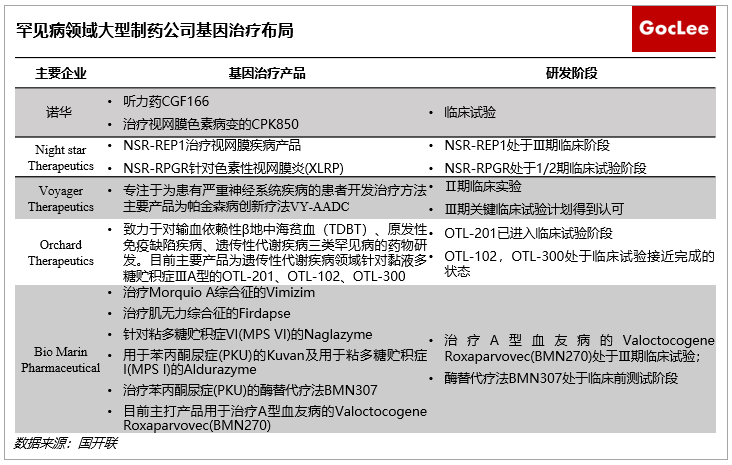
当前越来越多的大型制药公司正在通过并购、或与基因疗法药企深度合作的方式扩大或引入自身在基因治疗的业务板块,罕见病、癌症成为基因治疗的重要应用领域,未来应用前景广阔。在罕见病应用领域,诺华、Nightstar Therapeutics针对视网膜病变等研发出新产品,目前正处于临床试验阶段;Voyager Therapeutics专注于神经系统疾病研发出新疗法;Orchard Therapeutics、BioMarin Pharmaceutical等聚焦于血液病和遗传性代谢病;在癌症应用领域,诺华、Kite Pharma、Adaptimmune Therapeutics等致力于血液瘤和实体瘤等应用领域取得基因疗法新突破。

开启肿瘤治疗新时代,CAR-T细胞治疗、溶瘤病毒逐步成为基因治疗主流
自2013年以来,肿瘤免疫治疗已逐步被证明是继化疗,放疗之后的另一种行之有效的肿瘤治疗方法。除了免疫抑制剂获得关注外,溶瘤病毒及CAR-T也被证明是有效的免疫治疗手段。CAR-T细胞疗法通过构建表观游离环状DNA而修饰T细胞,从而大幅降低其基因毒性,为T细胞治疗提供更安全的平台;肿瘤病毒疗法则通过修饰溶瘤病毒表面,诱导溶瘤病毒表达免疫调节因子,从而进一步提高免疫疗效。目前两种疗法作为单一治疗的安全性已在众多临床试验中得到证实,逐步成为基因治疗主流。
CAR-T细胞治疗逐步走向成熟,在肿瘤治疗中应用前景广阔。嵌合抗原受体T细胞(chimeric antigen receptor T cells,Car-T细胞)疗法作为近十年来免疫医学的重大突破领域,其在肿瘤治疗中的应用具有诱人前景。Car-T细胞对于血液恶性肿瘤具有独特的疗效,目前各大制药公司与创新型公司纷纷抢占Car-T细胞治疗市场。Novartis与Gilead走在该领域的最前列,已有产品被美国FDA批准上市,Celgene与Merck等公司已有多种产品进入临床试验,第二代Car-T细胞成为Car-T领域的主流;在实体瘤治疗方面,虽然Car-T细胞疗法仍然束手无策,但目前在第四代Car-T细胞疗法已有针对实体瘤的实验,随着科学家们不断创新,CAR-T细胞治疗将逐步走向成熟。
基因工程改造的溶瘤病毒或将成为癌症治疗重要武器,应用前景可观。溶瘤病毒用于肿瘤治疗的研究发展非常迅速,目前国际上已有3款产品获批上市,还有部分产品也已经进入了临床3期阶段,溶瘤病毒有望成为治疗肿瘤的重要武器。溶瘤病毒(oncolytic virus)是利用靶细胞中抑癌基因的失活或缺陷从而选择性地感染肿瘤细胞,在其内大量复制并最终摧毁肿瘤细胞,其用于肿瘤的治疗已经有近60年的历史,已有大量研究对病毒的改造、给药途径探索、疗效观察、机制及危险性等方面进行了广泛探讨,对溶瘤病毒的认识有了很大进展。由于溶瘤病毒所用的病毒载体是经过特殊的基因质粒组装而成的具有复制活性的病毒,与其他用于肿瘤基因治疗的载体相比,溶瘤病毒在理论上具有更高的效率,未来在肿瘤治疗领域临床应用前景可观。
以CRISPR为代表的新一代基因编辑突破技术限制,临床应用前景广阔
当前市场最常见的基因编辑工具酶有ZFN、TALEN和CRISPR-Cas9,然而,由于ZFN的专利被垄断,且合成难度大,因此更为简单易用的CRISPR技术得到了越来越多的关注和应用。目前以CRISPR为代表的基因编辑技术研究已经取得突破,未来有望为艾滋病、镰刀型贫血、血友病、β地中海贫血等血液系统相关疾病的治疗带来新的曙光,临床应用前景广阔。2018年8月,由CRISPR Therapeutics发起的以CTX-001在体外通过电穿孔的方式将CRISPR系统引入患者CD34+ HSC并回输,从而治疗β-地中海贫血(TDT)和镰状细胞病(SCD)的临床试验正式启动,同年10月,FDA批准了CTX-001用于治疗SCD的IND,目前该公司已经启动A型血友病和SCID的临床前研究;2019年9月,北京大学-清华大学生命科学联合中心的邓宏魁等人首次完成基因编辑干细胞治疗艾滋病和白血病患者。其研究显示:利用CRISPR/Cas9技术,科学家对人造血干细胞进行基因编辑,基因编辑后的干细胞在动物模型中可长期稳定重建造血系统,并且其产生的外周血细胞具有抵御艾滋和白血病能力。目前研究结果已发表在顶级医学期刊《新英格兰医学杂志》(The New England Journal of Medicine)上。
中亚哈乌两国深度商务考察团招募公告(2025年12月期)
2025.12.01元.链加出海 · 商务考察
中亚地区正以“年轻人口+资源红利+政策开放”组合优势,成为全球价值链重构的关键一环。
生物医药与健康产业招商图谱(招商地图)系列
2025.06.12面议元.医药健康
按照“4.0版招商地图”的研究逻辑,综合推出的一款“普惠型招商地图”产品。
中医药行业研究报告(综合) 2024
2024.01.0529800元.生命健康
《报告》重点由中药材种植、中药制造和中医大健康服务三大部分组成,全面呈现中医药行业投资价值与未来趋势。
中山推进粤港澳大湾区建设产业发展规划 国开联.区域产业规划 中山作为湾区重要节点城市,如何抢抓政策红利,争建湾区战略性平台,承接中心城市转移产业,共享中心城市产业创新要素资源与平台,以达至中山“湾...
宁夏先进制造业招商行动计划 国开联.招商图谱与项目包装 我单位受托制定宁夏全区先进制造产业招商行动计划,深度剖析全区智能制造产业基础、结构和产业承载优势,明确自治区智能制造产业发展方向与未来招...
九省市如何借招商地图(图谱)实施专业招商? 国开联.产业链招商与链长制 产业招商引资专业化、精细化、市场化已渐成业界共识,然而,如何实施专业化招商,如何进行精细化部署,又如何借助市场化的手段来提高招商引资实效...
产业链招商图谱与招商地图,区别在哪里? 国开联.产业链招商与链长制 招商工作越来越趋于专业化、精准化和市场化,招商从业者也越来越意识到产业招商专业化的重要性。
招商引资项目评估 国开联.产业链咨询 第三方独立评估,助力项目落地。
战略新兴产业规划编制 国开联.热点议题 我们的成功案例遍及全国30省(区、市),连续获得客户信赖和委托。